Pengertian Alkena
Alkena atau olefin merupakan senyawa
hidrokarbon alifatik tidak jenuh yang sangat reaktif dan memiliki rumus umum CnH2n.
Alkena dikatakan tidak jenuh karena memiliki gugus ikatan rangkap antar atom
karbon. Terbentuknya ikatan rangkap ini menyebabkan alkena memiliki jumlah H
yang lebih sedikit apabila dikaitkan jumlah atom C. Ikatan rangkap yang
terdapat pada alkena merupakan ciri khas pada senyawa-senyawa alkena.Untuk
hidrokarbon alifatik tidak jenuh yang memiliki dua ikatan rangkap karbon-karbon
pada molekulnya dinamakan alkadiena.
Sifat-Sifat Alkena
Sifat Fisika
Alkena merupakan senyawa nonpolar
sehingga tidak larut dalam air dan memiliki massa jenis lebih kecil dari air.
Alkena dapat larut dalam alkena lain, pelarut-pelarut nonpolar dan etanol. Pada
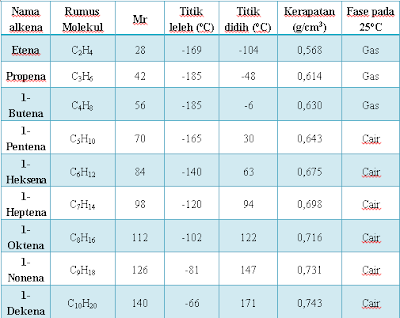
temperatur kamar alkena yang memiliki dua, tiga dan empat atom karbon berwujud
gas. Sedangkan Alkena dengan dengan berat molekul lebih tinggi dapat berupa
cair dan padatan pada suhu kamar.
- Sifat kimia
Umumnya alkena lebih aktif dari alkana. Ikatan rangkap
yang dimiliki alkena merupakan ciri khas dari alkena yang disebut gugus fungsi.
Reaksi terjadi pada alkena dapat terjadi pada ikatan rangkap dapat pula terjadi
diluar ikatan rangkap. Reaksi yang terjadi pada ikatan rangkap disebut reaksi
adisi yang ditandai dengan putusnya ikatan rangkap (ikatan π) membentuk ikatan
tunggal (ikatan α) dengan atom atau gugus tertentu. Selain sifat-sifat tersebut
dapat mengalami reaksi polimerisasi dan bereaksi dengan oksigen (pembakaran).
1.
Alkena dapat mengalami adisi
Adisi adalah pengubahan ikatan rangkap (tak
jenuh) menjadi ikatan tunggal (jenuh) dengan cara menangkap atom/gugus lain.
Pada adisi alkena 2 atom/gugus atom ditambahkan pada ikatan rangkap C=C
sehingga diperoleh ikatan tunggal C-C. Beberapa contoh reaksi adisi pada
alkena:
§
Reaksi alkena dengan halogen (halogenisasi)
§
Reaksi alkena dengan hidrogen halida (hidrohalogenasi) Hasil
reaksi antara alkena dengan hidrogen halida dipengaruhi oleh struktur alkena,
apakah alkena simetris atau alkena asimetris.
§
Reaksi alkena dengan hidrogen
(hidrogenasi)
2.
Alkena dapat mengalami polimerisasi.
Polimerisasi adalah penggabungan molekul-molekul
sejenis menjadi molekul-molekul raksasa sehingga rantai karbon sangat panjang.
Molekul yang bergabung disebut monomer, sedangkan molekul raksasa
yang terbentuk disebut polimer.
3.
Pembakaran Alkena
Pembakaran
alkena (reaksi alkena dengan oksigen) akan menghasilkan CO2 dan H2O.
CH2=CH2 +
2 O2 → 2CO2 + 2H2O
Keisomeran Alkena
§ Keisomeran Struktur
Keisomeran struktur, yaitu keisomeran yang terjadi jika rumus
molekul sama, tetapi rumus struktur berbeda. Keisomeran pada alkena mulai
ditemukan pada C4H8
terus ke suku yang lebih tinggi. Perhatikan contoh di bawah ini!
C4H8 mempunyai tiga macam isomer, yaitu:
§
Keisomeran Geometri
Keisomeran
geometri,
yaitu keisomeran yang terjadi karena perbedaan orientasi gugus-gugus di sekitar
C ikatan rangkap. Ikatan rangkap dua karbon-karbon pada alkena
tidak dapat memutar (melintir) sebab jika diputar akan memutuskan ikatan
rangkap,tentunya memerlukan energi cukup besar. Oleh karena itu, alkena
dikatakan memiliki struktur yang rigid (tegar). Akibat dari
ketegaran, ikatan rangkap menimbulkan isomer tertentu pada alkena. Pada contoh
berikut, ada dua isomer untuk 2-butena(CH3CH=CHCH3),
yaitu cis-2-butena dan trans-2-butena.
Isomer
pada cis-2-butena dan trans-2-butena dinamakan isomergeometri. Isomer geometri
adalah isomer yang terjadi akibat perbedaan lokasi atom-atom atau gugus atom
dalam ruang tiga dimensi, sedangkan rumus molekul dan gugus terikatnya sama.
Perbedaan titik didih antaracis-2-butena (3,7°C) dan trans-2-butena (0,9°C)
menunjukkan bahwa kedua senyawa ini benar-benar ada dan berbeda, walaupun
keduanya memiliki rumus molekul sama (C4H8) dan gugus terikatnya sama.
Kegunaan Alkena
Alkena banyak digunakan sebagai bahan
baku untuk pembuatan senyawa organik di industri, seperti industri plastik,
farmasi, dan insektisida. Berikut beberapa contohnya.
1. Etena
Etena adalah bahan baku pembuatan polietena dan senyawa organik
intermediet (produk antara) seperti kloroetena (vinil klorida) dan stirena.
2. Propena
Propena digunakan untuk membuat polipropena, suatu polimer untuk
membuat serat sintetis, materi pengepakan, dan peralatan memasak.
3. Butadiena
Butadiena adalah salah satu alkadiena, yang melalui reaksi
polimerisasi akan membentuk polibutadiena (karet sintesis). Polibuitadiena
murni bersifat lengket dan lemah sehingga digunakan sebagai komponen adhesif
dan semen. Agar lebih kuat dan elastis, polibutadiena dipanaskan dengan
belerang melalui proses vulkanisir. Rantai-rantai polibutadiena akan bergabung
melalui rantai belerang. Setelah itu, zat kimia seperti karbon dan pigmen
ditambahkan untuk memperoleh karakteristik yang diinginkan.
Permasalahan :
Pada reaksi adisi halogen umumnya
hanyalah terjadi untuk klor dan brom, mengapa demikian? apakah reaksi adisi halogen tidak
berlaku untuk unsur halogen lainnya seperti fluor dan iodin?







Menurut saya, reaksi adisi halogen juga berlaku untuk unsur halogen lainnya seperti fluor dan iodin, hanya saja F2 maupun I2 bukan reagensia yang berguna dalam reaksi adisi alkena. Flour akan bereaksi dengan meledak jika direaksikan dengan senyawa organik salah satunya alkena. Untuk Iod sebenarnya juga dapat mengadisi ikatan rangkap pada alkena, membentuk produk 1,2-diodo yang sifatnya tidak stabil. Mengapa dikatakan tidak stabil? Hal ini dikarenakan produk 1,2-diodo akan mudah berubah kembali menjadi alkena pembentuknya dan I2 akan terlepas kembali.
BalasHapusPersaman reaksi sebagai berikut :
R2CI- CIR2 <===> R2C=CR2 + I2
Reaksi adisi adalah reaksi pemutusan rantai (pengubahan ikatan yang awalnya memiliki ikatan rangkap dan kemudian menjadi ikatan kovalen tunggal atau pengubahan ikatan tak jenuh menjadi jenuh).
BalasHapusAdisi juga diartikan sebagai penambahan. Sehingga reaksi adisi dapat juga dikatakan sebagai penambahan atom yang diikat oleh atom C yang semula memiliki ikatan rangkap.
Reaksi adisi halogen pada alkena tidak hanya dilakukan pada klor dan brom.Etena bereaksi eksplosif dengan fluorin menghasilkan karbon dan gas hidrogen fluoride. Reaksi ini bukan merupakan reaksi yang bermanfaat, dan jarang dibahas pada pembahasan tingkat dasar.
Klorin bereaksi lebih cepat dibanding bromin, tapi sifat kimia reaksi cukup mirip. Iodin bereaksi jauh lebih lambat, tapi sifat kimia reaksi juga mirip. Reaksi dengan bromin jauh lebih mungkin ditemui dibanding reaksi dengan klorin dan iodin.
Fluorin sangat reaktif sehingga sangat sukar mengontrolnya,sedangkan iodin sangat tidak reaktif, sehingga keduanya jarangdigunakan dalam reaksi ini
Assalamualaikum sam.
BalasHapussaya akan mencoba menjawab pertanyaan anda
reaksi adisi halogen umumnya hanyalah terjadi untuk klor dan brom karna klorin bereaksi lebih cepat dibanding bromin tapi sifat kimia reaksi cukup mirip, serta Bromin dan Klorin dapat mengadisi alkena.
Fluorin sangat reaktif sehingga sangat sukar mengontrolnya, sedangkan iodin sangat tidak reaktif, sehingga keduanya jarang digunakan dalam reaksi ini.
reaksi adisi halogen pada alkena yaitu reaksi dimana ikatan rangkap pada alkena diadisi oleh halogen menjadi ikatan tunggal. Bromin dan klorin dapat mengadisi alkena, sedangkan Fluorin sangat reaktif (eksplosif) sehingga sangat sukar mengontrolnya,
BalasHapussedangkan iodin sangat tidak reaktif, sehingga keduanya jarang
digunakan untuk reaksi adisi ini.
Klorin bereaksi lebih cepat dibanding bromin, walapun sifat kimianya cukup mirip. Iodin bereaksi jauh lebih lambat, dan sifat kimia reaksi juga mirip. Reaksi dengan bromin jauh lebih mungkin ditemui dibanding reaksi dengan klorin dan iodin.
terimakasih :)